タンパク質実験の基本的な手技の一つに、タンパクの染色があります。この記事では、代表的な染色方法をとりあげその原理やメリット・デメリットを紹介します。
タンパク染色の概要
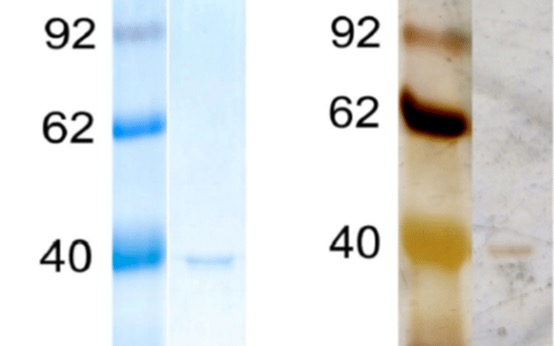
ポリアクリルアミドゲル中のタンパク質の位置は、通常はクマシーブルー染色(CBB染色)または銀染色で検出されます。CBBはより簡便で迅速な方法で、一方の銀染色法はかなり感度が高いのでより少量のタンパク質を検出することができます。他にSYPRO OrangeやSYPRO RED蛍光染色が使われることもあり、これはCBB染色よりも感度が高く、銀染色と同程度の感度を持つことが多いため、従来の染色法に代わる方法として注目されています。
CBB染色
CBB (Coomassie brilliant blue) は、現在でも簡単で安価なタンパク質の可視化法として使われています。濃い青色のタンパク質を目視で確認できることや、改良型のプロトコルにより従来よりも迅速かつ感度の高い結果が得られるようになったなどが一因として挙げられます (Proteomics 2006)。CBBは酸性染色液中では陰イオンとして働き、タンパク質のNH3+基と非特異的に相互作用することでタンパクを検出します (Biochim. Biophys. Acta 1963)。CBBは一方でポリアクリルアミドゲルには結合しないので、タンパク質があるところは透明なポリアクリアルアミドゲル中の青いバンドとして検出されます。
タンパク質の電気泳動後、古典的なCBB染色は8 ~ 12 時間必要ですが、これをより早める工夫によって1時間程度でCBB染色結果を得ることもできます。大量に調製するリコンビナントタンパクの発現チェックなどには迅速CBBで十分な用途かと思います。
銀染色
銀染色は写真フィルムの現像と同じで銀イオンの還元を利用したものになっています。やり方は主に2種類あり、塩基性溶液を使った銀ジアミン錯体の還元(Anal. Biochem. 1980)に基づく方法と、酸性溶液を使った銀イオン還元(Morrissey、1981)に基づく方法があります。銀染色の原理は優れた総説がある (Nature 1990; Electrophoresis 1990)のでここでは深入りしませんが、銀イオンやその複合体は、システイン、リジン、アスパラギン酸、グルタミン酸、ヒスチジンなどのいくつかのアミノ酸と相互作用してタンパク質に結合します (Electrophoresis 1990)。タンパク質と相互作用している銀を選択的に還元することで可視化が可能になるのですが、ある特定のアミノ酸に依存しているため、組成依存的な染色となることに注意です。つまりCBBと違ってすべてのタンパク質が銀染色に対して同じ強さの染色を示すとは限らないのです。
銀染色は、CBBの100倍以上の低濃度 (フェムトモルレベルのタンパク質)でも検出できるというのが強みで、その染色プロトコルはもともとBloomらによって発表されました (Electrophoresis 1987)。
一方で銀染色は高感度であるからこそ不純物や染色アーチファクトの影響を受けやすいという弱点もあります。アーチファクトを避けるため、ポリアクリルアミドゲルおよびすべての染色液は、高品質の試薬から調製することが必須で、特に重要なのは高品質の水(MilliQなど)を使用することです。また、銀が残らないように使用したガラス器具や染色に使用したプラスチック容器は特に念入りに洗浄する必要もありますし、銀が含まれる廃液は特殊な処理が求められます。
銀染色に必要な時間はタンパク質の電気泳動後約5時間程度です。固定時間をもっと伸ばして都合のいいときに銀染色をすることも可能です。また、迅速銀染色法を使えば30分ほどで可視化することもできます。
蛍光染色
タンパク質の蛍光染色、特にSYPRO Orange/Redを使った染色は、CBB染色よりも高感度で、多くの銀染色アプローチに匹敵する感度を持っています。染色は1時間未満で完了しますし、電気泳動後にゲルを染色し、すすぎ、写真撮影するだけという手軽さもあります。別途固定や脱染の工程は必要ありません (Anal. Biochem. 1996)。ここで使われる蛍光色素はゲル中のタンパク質の周りにあるSDSと相互作用するので、銀染色と比較して異なる種類のタンパク質間でより一貫した染色を行うことができます。また、細胞や組織抽出液から調製したタンパク質に含まれる核酸やリポ多糖には反応しないというのもメリットです。SYPRO シリーズの染色はタンパク質と共有結合しないため、タンパク質を切りだしてそのまま回収し、質量分析などにかけるということもできます。
蛍光染料にはメーカーによって推奨濃度が提供されており、それ以下に希釈した場合には染色感度が低下します。逆に推奨濃度より高い濃度で染色すると、バックグラウンドが増加し、タンパク質の周りに密集した色素による蛍光がバックグラウンドと見分けがつきにくくなってしまいます。
染色時間はゲルの厚さやアクリルアミドの割合に依存しますが、1mm厚、15%ポリアクリルアミドゲルの場合、通常45分程度の染色で蛍光シグナルは最適になります。
まとめに代えて
この記事では、タンパク染色に関する基本事項について紹介しました。
タンパク質の取り扱いはバイオ実験の基本事項であり、それをイラストつきで解説してくれているのがこちらの本です。
生命科学の基本的な実験手法について、その原理をふくめてしっかりとまとめたバイブルの1つがMolecular Cloningです。研究室に1冊常備されているととても便利です。
タンパク研究法については、このような関連記事があるので合わせてご覧ください。
今日も【生命医学をハックする】をお読みいただきありがとうございました。当サイトの記事をもとに加筆した月2回のニュースレターも好評配信中ですので、よろしければこちらも合わせてどうぞ