遺伝子編集技術として知られているCRISPRを使って、がん細胞の生存に必須の融合遺伝子を同定したという論文がNature Communications誌に発表された。原題は「Functional linkage of gene fusions to cancer cell fitness assessed by pharmacological and CRISPR-Cas9 screening」だ。
融合遺伝子とは
もともと2つの別々の遺伝子だったが、がんではそれが異常に融合して1つになっていることはよくあり、有名なものとして慢性骨髄性白血病のBCL-ABL融合遺伝子が知られている。
日本人も融合遺伝子には貢献している。例えばALK融合遺伝子は間野博士らが2007年に報告し、今ではこの融合遺伝子を持つ非小細胞肺がんの患者さんにクリゾチニブ (商品名ザーコリ) という薬が使われている。
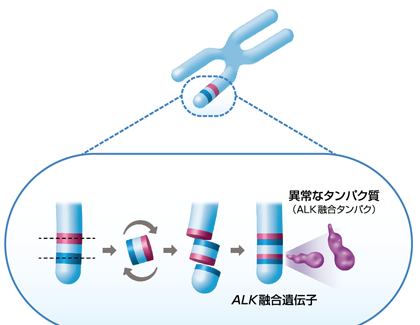
Source: http://www.zykadia-info.jp/p_about/index.html
融合遺伝子は現在、あるがん患者がどの薬に反応するかを予測する診断ツールとして、また最善の治療を受けた患者の予後を予測するために使用されている。
BCR-ABL融合に対する特効薬イマチニブのような、いくつかの治療薬の標的でもある。
これまでに約20,000の遺伝子融合が知られているが、その正確な機能や癌の発症における役割は未だよく分かっていないままだ。
CRISPRスクリーニングで生存に必須な融合遺伝子を網羅的に解き明かす
今回、研究者らはCRISPRという遺伝子編集技術を応用し、43種類の癌から1,000以上のヒト癌細胞株で8000以上の遺伝子融合を分析した。
その結果、融合遺伝子の90%が癌において本質的な役割を果たしていないことを発見した。
生存に必須の融合遺伝子の発見で、より高精度にがんだけを狙い撃ちにする薬の開発につながりうる。
逆に遺伝子融合の大部分は癌細胞の生存に必須ではないということは、ゲノムシークエンシングのデータを解釈する人は、特定の遺伝子融合が癌を引き起こしているかどうかを検討するときには注意が必要だ。
それだけでなく、研究者らは脳腫瘍や卵巣がんなどの複数のがんの進行に不可欠である、これまで未知だったYAP1-MAML2融合遺伝子など複数を発見した。
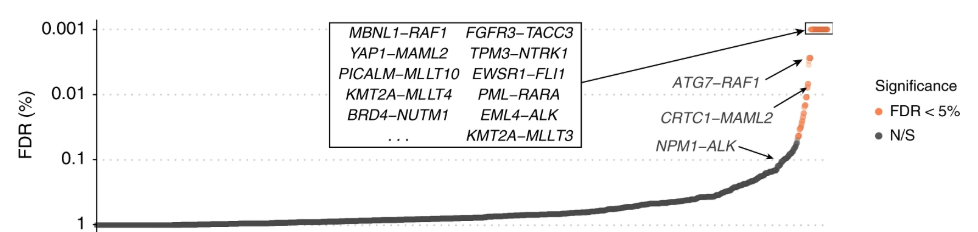
Source: https://www.nature.com/articles/s41467-019-09940-1
また、RAF1、ROS1およびBRD4遺伝子などの融合遺伝子がこれまで開発されている薬物の標的となる可能性を示しており、これらの遺伝子融合を持つ患者さんにとって新たな治療選択肢を将来的に提供するものだ。
この研究の意義
がんは人によって異なり、これらの違いをゲノムで見ることでがんに対する理解が深まり、患者さんの治療法の選択肢が広がっていく。
今回の研究は、治療用バイオマーカーとして遺伝子融合を調べ、よりターゲットを絞った効果的な戦略を提供する手がかりになるだろう。