百聞は一見にしかずという言葉もあるように、生命科学研究にも観察はとても重要です。
蛍光タンパクを使った可視化は今では非常によく行われるようになり、また今でも蛍光タンパクの改良は続けられています。
この記事では、GFPに代表される蛍光タンパクの改良の歴史をダイジェスト版でお届けします。
海洋生物由来の「古典的な」蛍光タンパク
緑色蛍光タンパク質(GFP) はオワンクラゲの蛍光性をもつタンパク質で、1960年に下村脩 先生によって報告されました (下村先生はこの発見で2008年のノーベル化学賞を受賞しています)。
1994年に、そのGFPが蛍光タグとして機能することが初めて実証された (Green Fluorescent Protein as a Marker for Gene-Expression. Science 1994) のを皮切りに、生命医学領域の研究者もこぞってGFPを使うようになり、その生化学的な特性の解明や、蛍光特性を変化させ青やシアン・黄色といった異なる色の蛍光タンパクの開発がタンパク工学によって急速に開発されていきました。
また、オワンクラゲ以外の他の海洋生物のさらなるゲノム探索により、別の生物の蛍光タンパクの発見にもつながりました (Fluorescent proteins from nonbioluminescent Anthozoa species. Nat. Biotechnol. 1999)。
例えばDsRedとそれに続くmFruit系の蛍光タンパクを生み出したDiscosoma striata (サンゴの一種) や、eqFP・TagRFP・mKate・mRuby誘導体などを生み出したイソギンチャクEntacmaea quadricolorなどがあります。これらの海洋動物から得た蛍光タンパクもまた同様にさまざまな色の蛍光タンパクへ改変されていきました。
蛍光タンパクの本質的な蛍光輝度は、分子消光係数(ε)と蛍光量子収率(Φ)の積に比例するものの、実際には細胞内の見かけの明るさは、それ以外の環境要因に大きく依存しています。
したがって、これまでなされてきた多くの突然変異戦略は、コドンの使用を最適化することによって遺伝子の発現を改善したり、タンパク質の折り畳みを促進したり、発色団の成熟の程度と速度を促進したり、pHや酸素濃度などの影響を制御してタンパク質の安定性を高めることを目標としてきました。
ほとんどの蛍光タンパクは天然では二量体や四量体として存在するため、タンパク工学でこれを単量体にするという試みもなされてきました。
現在でもまだ改良の途中で、次々に新しい蛍光タンパクが登場しています。例えばmClover3 (Improving brightness and photostability of green and red fluorescent proteins for live cell imaging and FRET reporting. Sci. Rep. 2016) とmNeonGreen (A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nat. Methods 2013)という2つの新しいGFPは、GFPの最初の報告から20年も経ってから報告されたEGPの改良版で、明るさはmEGFRの約2.5倍もあるそうです。
これまでに開発された主な蛍光タンパクを、横軸に波長、縦軸にEGFPを基準の1としたときの相対的な明るさをプロットするとこのようになります。
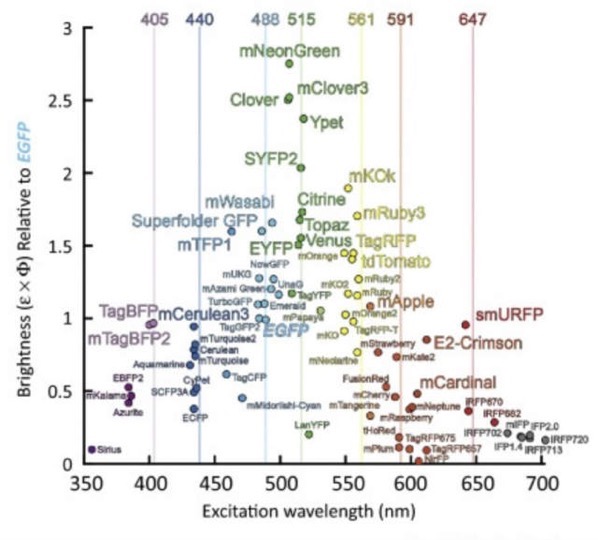
(Trends Biochem. Sci. 2017より引用)
近赤外蛍光タンパクの開発
波長の長い赤外光は組織のより深部まで到達できるので、赤外領域の蛍光タンパクを開発することはin vivoイメージングへの活用などさまざまな用途が見込めます。
近赤外領域で励起されるGFPホモログが海洋生物で発見されていなかったこともあって、研究者らはこれを達成するために細菌性フィトクロム(BphPs)に注目してきた経緯があります。
BphPsは、植物の赤/遠赤光受容体スーパーファミリーに属していて、一般的に約650〜700 nmで最大吸光度を示します (Phylogenetic analysis of the phytochrome superfamily reveals distinct microbial subfamilies of photoreceptors. Biochem. J. 2005)。
哺乳類のイメージングにBphPを利用した最初の例は、放射線耐性生物としてよく知られたグラム陽性細菌Deinococcus radiodurans由来のBphPを改変して作ったIFP1.4で、研究者らはこれをマウスの肝臓の蛍光イメージングに応用しました (Mammalian expression of infrared fluorescent proteins engineered from a bacterial phytochrome. Science 2009)。
その後、Rhodopseudomonas palustrisというグラム陰性細菌のBphPを改変したiRFPが作製され、輝度を向上させた赤外領域のイメージングに成功しています (Bright and stable near-infrared fluorescent protein for in vivo imaging. Nat. Biotechnol. 2011)。
タンパク質への融合タグとして使うためには、もともとのタンパク質の機能やトラフィッキングなどへの融合を最小限にするため、赤外領域の蛍光タグをなるべく単量体にする必要があります。
その目的で作られたのがmIFP (monomeric Infrared Fluorescent Protein) で、生きた細胞や生物のさまざまなタンパクのイメージングに使われてきました (A naturally monomeric infrared fluorescent protein for protein labeling in vivo. Nat. Methods 2015)
mIFPはタグとして有望ですが、iRFPと比べると5倍程度暗いということもあり、将来的にはタンパク工学の手法を駆使してより望ましい蛍光タグの開発が待たれます。
脊椎動物由来の蛍光タンパク
これまで海洋生物や細菌といった無脊椎動物由来の蛍光タンパクを紹介してきましたが、近年は脊椎動物の蛍光タンパクもあります。
そのような脊椎動物の一つにAnguilla japonica (ニホンウナギ) があり、骨格筋は緑色の蛍光を示します (A novel fluorescent protein purified from eel muscle. Fish. Sci. 2009)。
この緑色蛍光の原因となるUnaG (Unagiと Green fluorescent proteinが命名の由来) 遺伝子は、脂肪酸結合タンパク質(FABP)ファミリーの16.9 KDaのポリペプチドをコードしていることが分かりました (A bilirubin-inducible fluorescent protein from eel muscle. Cell 2013)。
UnaGはそれ自体は蛍光性を持ちませんが、ビリルビンと高い親和性・特異性(Kd = 98 pM)で結合することで明るい緑色の蛍光を発するようになっていたのです。
UnaGはGFPより小さく (GFPの約27 kDaに対してUnaGは約17 kDa)、例えばウイルスベクターへのパッケージングの観点でメリットが有り、さらに血清に含まれるビリルビンが供給されるだけで蛍光を発するのでin vivoで使いやすいという強みもあります。
海洋生物や細菌由来の蛍光タンパクと同様、今後さらに改良されていくのでしょう。
関連図書
この記事に関連した内容を紹介している本やサイトこちらです。
今日も【生命医学をハックする】 (@biomedicalhacks) をお読みいただきありがとうございました。
当サイトの記事をもとに加筆した月2回のニュースレターも好評配信中ですので、よろしければこちらも合わせてどうぞ