タンパク質を改変する際、それが安定なタンパクになってほしいというケースはよくあります。不安定なタンパクは発現させてもすぐに意図した機能を発揮してくれなくなってしまいます。
安定なタンパクをデザインするためには、いくつか基本のルールがあります。この記事では、タンパク工学の基本的なルールを5つ紹介します。
この記事の内容
ジスルフィド結合を増やす
ジスルフィド結合の形成は、多くのタンパク質の立体構造を維持するために必要であり、特に細胞外 (酸化的な環境)に分泌されるタンパク質にとって特に重要です。
タンパク工学でタンパク質の安定性を高める比較的簡単な方法は、新たなジスルフィド結合を入れることです。ポリペプチド鎖に2つのシステイン残基を導入すると、酸化条件の下で導入した2つのシステインが空間的に近い状態に折りたたまればジスルフィド結合が形成されます。
一般的には、2つのシステイン間のアミノ酸数が多いほど、安定性の増加につながることが分かっています。しかしながら、2つのシステインが適切な場所に配置されていないと、ジスルフィド結合の形成により歪んだ構造になり、タンパク質の安定性が低下してしまう可能性もあります。
このように、この方法はタンパク質の3次構造を知っている必要があります。ウェブベースでも簡単に操作できる3次元構造ビューワーもあり、タンパクの構造を可視化するデータベースとwebツール 【初めてでも直感的に使える】で紹介しています。
例えば細菌ウイルスT4由来の酵素であるリゾチームの安定性を高めるためにこのアプローチが取られました。この酵素の構造はX線結晶構造解析によって解明されていて、164アミノ酸のポリペプチド鎖は2つのドメインに折り畳まれており、野生型タンパク質ではどちらもジスルフィド結合形成に関与していない2つのシステインを持っています。
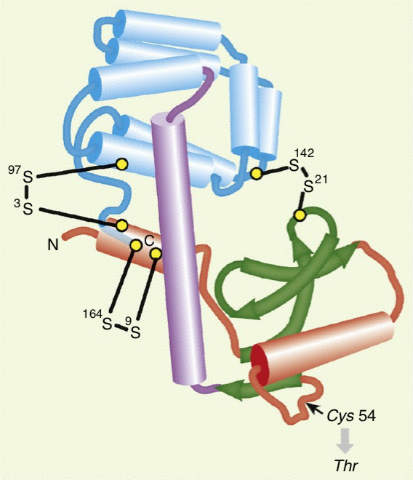
これらのうちの1つ、Cys54はジスルフィド結合の形成に関わってしまうのを避けるために最初にThrに変換しておきました。もう一つのCys97とジスルフィド結合ができる可能性のある場所を分析し、実験的にテストするために、5つのアミノ酸 (Ile3、Ile9、Thr21、Thr142、Leu164)を様々な組み合わせでCysに変換し、個々のタンパクを安定性および酵素活性について調べました。
これらはすべてタンパク質の安定性を向上させ、ほぼすべての酵素活性も保持していたようです。
グリシンやプロリンの数を変える
ジスルフィド結合を増やすことはタンパク質の安定性を向上させる最も単純で最も効果的な方法ですが、他の様々な方法も有効な場合があります。
エントロピーの効果のため、折りたたまれていないコンフォメーションの数 (状態数) が多ければ多いほど、タンパク質は折りたたまれていない可能性が高くなります。
そのため、折りたたまれていない状態の数を減らすことで、タンパクの安定性を増すことができます。例えばR基が水素原子であるグリシンは他のアミノ酸残基よりもコンフォメーションの自由度が高いですが、対照的にプロリンは最も自由度が低いアミノ酸です。
つまりグリシンを他のアミノ酸に置き換えるか、またはポリペプチド鎖中のプロリン残基の数を増やすことで、安定性を高めることになります。もちろん機能ドメインではない部分で、タンパク質の構造を変化させないようにしつつ、という条件がつきます。
疎水性ポケットを埋める
疎水性残基はタンパク質の中心部に集まる傾向がありますが、疎水性コアに空洞が存在する場合、その空洞を埋めることでタンパク質の安定性が向上します。
これは、すでに疎水性コアの中やその近くにある小さな疎水性残基をより大きなものに置き換えることによって行うことができます。例えば、アラニンをバリンに変更したり、ロイシンをフェニルアラニンに変更したりすることで、このようなことが可能です。
しかし、より大きな疎水性アミノ酸に置換すると、それらの側鎖が原因で好ましくない立体構造になってしまい、安定性が落ちてしまいます。
アルファヘリックス構造の末端のアミノ酸を改変する
アルファヘリックスは非対称構造なので、N末端でわずかに正の電荷、C末端でわずかに負の電荷を持ちます。
アルファヘリックスの末端近くに、反対電荷 (N末なら負の電荷、C末なら正の電荷) を持つアミノ酸残基が存在すると、安定性が促進されます。実際、天然のタンパク質では、大部分のαヘリックスはこのように安定化されています。
しかし、このような安定化残基がない場合には、タンパク工学によって安定化させるような残基を作り出すことができるかもしれません。
アスパラギンとグルタミンをスレオニンにする
アスパラギン残基とグルタミン残基は比較的不安定です。なぜならば、特に高温または極端なpHだと、これらは対応する酸 (つまりアスパラギン酸とグルタミン酸) に変換してしまうからです。
そのためAsnやGlnを同等の大きさの無電荷の親水性残基、具体的には例えばThrで置換するようにタンパク質を設計することで回避できることがあります。
関連図書
この記事に関連した内容を紹介しているサイトや本はこちらです。
タンパクの構造を可視化するデータベースとwebツール 【初めてでも直感的に使える】
今日も【生命医学をハックする】 (@biomedicalhacks) をお読みいただきありがとうございました。当サイトの記事をもとに加筆した月2回のニュースレターも好評配信中ですので、よろしければこちらも合わせてどうぞ