生命科学系の実験をしていると、タンパク質を精製することがよくあります。
この記事では、主に学生さんに向けて、まだあまり入門書には載っていないやや発展的なタンパク質精製タグについて紹介します。
この記事の内容
これまでのタグ
細胞系で働くタンパク質の機能は多様であり、それらの役割を十分に解明するには、解析したいタンパクに目印 (タグ) をつけることが望ましいです。
抗体は、タンパク質の機能を解読するのに役立つ重要なツールであり、多くのタンパク質について抗体が作られました。
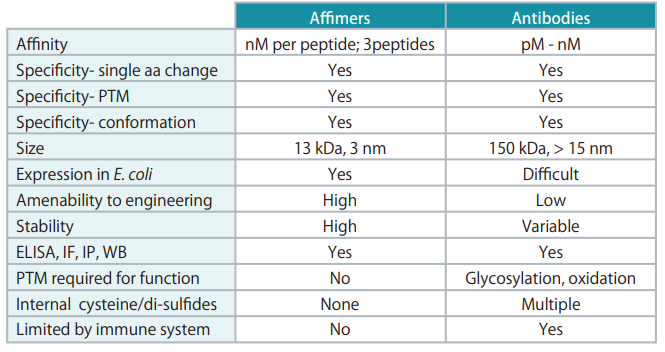
※ 最近はsingle-domain antibody fragments や afimers (抗体と同じように様々なところで使用できる約13 kDaの小分子。詳細はAffimer proteins are versatile and renewable affinity reagents. eLife. 2017を参照) もあります。
https://www.cosmobio.co.jp/upfiles/catalog/pdf/catalog_12173.pdf
Human Protein Atlasプロジェクトのような国際的な研究にも関わらず、現実的に全てのタンパクそれぞれに高いレベルの親和性/特異性を持つ抗体はできず、しかも抗体が認識するエピトープはしばしば折りたたみ構造や結合パートナーとの相互作用の結果マスクされてしまいます。
そこで、目印であるタグをつけたタンパクを作成し、それをトランスフェクションなどで細胞等に導入し、タンパクそのものではなくタグに対する抗体を使うことで多くの研究がなされてきました。
しかし、この方法の欠点の1つは、タグ融合タンパク質が生理的なレベルよりもずっと高発現になってしまうことです。
その結果、タンパク質複合体形成に障害が出て、タンパク質のフォールディングに影響を与え、さらに下流の機能を妨げることがあります (The transience of transient overexpression. Nat. Methods. 2013)。
しかも、これらのプラスミドは1つのコーディング配列を入れるので、目的の遺伝子によってコードされる可能性のあるプロテオフォームを発現できないという問題もあります (How many human proteoforms are there?, Nat. Chem. Biol. 2018)。
TALENやCRISPRといった遺伝子編集技術が2005年以降盛んに使われるようになり、生命科学のあらゆる側面を書き換えているのはご存知の通りです。
これらの技術で、従来は不可能だった内在性のタンパクにタグを付けることもできるようになり、タグノックイン細胞株を作製することが標準的になりつつあります (A generic strategy for CRISPR-Cas9-mediated gene tagging, Nat. Commun. 2015)。
古典的にはFLAGタグ (A short polypeptide marker sequence useful for recombinant protein identification and purification. Nat. Biotechnol. 1988) やeGFPタグ (Green fluorescent protein as a marker for gene expression, Science 1994)が使われてきましたが、近年いくつかの新しいタグが開発され, タンパクの機能や局在化、相互作用などさまざまな知見が得られるようになってきました。
どのタグにもそれぞれ長所と長所があるので、研究の開始時には目的に適したタグを慎重に選ぶ必要があります。
古典的なタグについては、すでに定評がありしっかり書かれた素晴らしい本がいくつもありますので、この記事では割愛します。
この記事の残りの部分では、まだこの2冊には載っていない、発展的なタグを中心に紹介します。
ペプチドタグ
タグの欠点は、付加された配列がタンパク質に意図しない影響を及ぼす可能性があることです。
さらに、いくつかのタグは予想外のモチーフを持っていることもあります。例えば、よく使われているHAタグの中にはcaspaseにより認識される部位があり、アポトーシスのときには使えなくなる場合があることは意外と知られていません (The HA tag is cleaved and loses immunoreactivity during apoptosis. Nat. Methods. 2007)。
タグが大きくなると意図しない作用が見られる可能性も多くなるので、多くのグループは小さなペプチドタグを使用しています。
まず、比較的小さなペプチドタグを見ていきます。
精製用ペプチドタグ
マウスのポドプラニン (podoplanin) 由来である二つのタグ、MAPタグ(12アミノ酸, MAP Tag: a novel tagging system for protein purification and detection. Monoclon. Antib. Immunodiagn. Immunother. 2016) とRAPタグ (12アミノ酸, Development of RAP Tag, a novel tagging system for protein detection and purification. Monoclon. Antib. Immunodiagn. Immunother. 2017)は、それぞれラットantiマウスおよびマウス抗ラットpodoplaninモノクローナル抗体に結合します。
PAペプチドタグはヒト抗ポドプラニン抗体NZ‐1に認識されます (12アミノ酸、PA tag: a versatile protein tagging system using a super high affinity antibody against a dodecapeptide de-rived from human podoplanin. Protein Expr. Purif. 2014)。
これらのタグは、ウェスタンやタンパク質精製を含むさまざまな用途に使用することができます。
ヘパリン結合親和性(HB)タグは、タンパク質産生目的のために特異的に開発されました (34アミノ酸, Heparin-binding peptide as a novel affinity tag for purification of recombinant proteins. Protein Expr. Purif. 2016)。
大腸菌で産生されたタンパク質の精製を行うタグとして開発されたFh8タグ (69アミノ酸, The novel Fh8 and H fusion partners for soluble protein expression in Escherichia coli: a comparison with the traditional gene fusion technology. Appl. Microbiol. Biotechnol. 2013)は、Fasciola hepaticaに見られるカルシウム結合タンパク質にヒントを得ています。MBPタグなどと同様に、Fh8タグはタグとしての機能だけではなく融合タンパク質の溶解度を増加させることができます。
定量用ペプチドタグ
ペプチドタグの中には、タグがついたタンパク質の正確で高感度な定量のために作られたものもあります。その代表がHiBiTタグです。
HiBiT系は,小さなルシフェラーゼ変異体であるNanolucを応用した発光検出系です(Application of a novel HiBiT peptide tag for monitoring ATF4 protein expression in Neuro2a cells.Biochem. Biophys. Rep. 2017)。
タンパク質にHiBiTペプチドタグをつけ、ここにLgBiTを混ぜると、HiBiTとLgBiTが定量可能なNanolucを再構成します。
あるいは、2つのタンパクにこれらのタグをつけておくと、2種類のタンパク質が相互作用するときにのみ発光が見られます。
特殊なペプチドタグ
SpyTag/SpyCatcher系のような、以前から存在するタグのいくつかは、有用性をさらに高めるために改良されています。
SpyTag/SpyCatcher系というのは、SpyTagとSpyCatcherタグの間で自然におきるイソペプチド結合の結果、両タンパク質の間に共有結合ができてつながるというシステムです (Structural analysis and optimization of the covalent association between SpyCatcher and a peptide Tag. J. Mol. Biol. 2014)。
同様のシステムとして、SnoopタグとSnoopCatcherタグの組み合わせが知られていて、これらもイソペプチド結合を形成しつながります (Programmable polyproteams built using twin peptide superglues. Proc. Natl. Acad. Sci. U. S. A. 2016)。
SpyTag/SpyCatcher系とSnoopTag/SnoopCatcher系の間は交差反応しないので、両者を併用することもできます。
SunTagは、ペプチドの反復からなっているので、複数の抗体がタグに結合することができます (24x19アミノ酸, A protein-tagging system for signal amplification in gene expression and fluorescence imaging. Cell 2014)。使用される抗体は、任意の他のタンパク質に遺伝的に結合でき、SunTagは、蛍光タンパク質や他の活性をもつタンパクを呼び込むための強力な足場を提供します。
オリジナルの論文では、dCas9にSunTagをつけることで、CRISPRで狙った任意の位置に多数のGFPや転写活性化因子を呼び込めることを示しています。
タンパク質タグ
上で述べたタグよりも少しサイズが大きいものの、有用なものを紹介します。
タンデムアフィニティー精製 (TAP)タグが最初に公表されてからというもの、多くのグループが似たようあマルチモーダルタグを開発してきました。
TAPアプローチは2種類のアフィニティータグを用いて精製純度を高める方法で、2つのタグの間にはプロテアーゼ (通常はタバコエッチウイルスのTEVプロテアーゼ) によって切断される部位があります(Affinity purification of protein complexes using TAP tags. Methods Enzymol. 2015)。
融合タンパクの遠位側のアフィニティータグで精製後、プロテアーゼの存在条件でインキュベートし不要なタグを切り出し、次に残った2番目のタグで精製することで非特異的なバックグラウンドを減らすことができます。
TAPタグは人気で、Saccharomyces cerevisiaeのオープンリーディングフレーム全部にタグを付ける (Proteome survey reveals modularity of the yeast cell machinery. Nature 2006) など、重要な論文も発表されています。
このように複数のパーツを持つタグは近年増えていて、例えばGSyellowタグ (325アミノ酸) はストレプトアビジン結合ペプチド(SBP)とシトリン黄色蛍光タンパク質(cYFP)が連結されているため、蛍光イメージングも精製も行うことができます (GS(yellow), a multifaceted tag for functional protein analysis in monocot and dicot plants. Plant Physiol. 2018)。
GFPは蛍光観察にしばしば使われるが、その蛍光タンパクの成熟はかなり遅いという問題があります。そのため、半減期が短いタンパク (胚発生に関わる転写因子など) にGFPタグをつけると、蛍光観察できるようになる前にGFP融合タンパク質が分解されてしまいます。
これを回避するために、LlamaTagが開発されました (123アミノ酸, LlamaTags: a versatile tool to image transcription factor dynamics in live embryos. Cell 2018)。このシステムでは、GFP蛋白質は転写因子とは無関係に発現し成熟します。目的の転写因子をGFPを呼び込むことができる単一ドメイン抗体断片に融合しているので、目的の転写因子が発現すると、成熟GFPがそこに動員され、微妙な差異を観察することができます。
タグを使用することは、タンパク質の機能を阻害するリスクを常に伴います。このリスクを最小限にするために、抗原性やエピトープのアクセス容易性などの多数のパラメータを使ってタンパク質ファミリーをトリアージするバイオインフォマティクススクリーニングの結果として開発されたのがInntagsで、これは IT5, IT6, IT10の3種類のタグ (それぞれ40, 43, 96アミノ酸) の総称です (Inntags: small self-structured epitopes for innocuous protein tagging. Nat. Methods. 2015)。
従来のタグと比較して、Inntagsは、特に強い相互作用を必要とするタンパク質の検出に特に優れた特性があります。
文献では、従来のFLAGやHAタグではアーチファクトが多く検出できなかった、サイクリン依存性キナーゼcdc28と酵母シャペロンYdj1の結合を示しています。
タンパク複合体の研究に使えそうな面白い技術としてVirotrapというものがあります (Trapping mammalian protein complexes in viral particles. Nat. Commun. 2016) 。
この技術は、HIV1型(HIV-1)p55GAGタンパク質を、調べたい対象のbaitタンパク質にまず融合します。すると、p55GAGタンパク質がウイルス様粒子(VLP)の形成を誘導し, baitタンパク質とその相互作用パートナーを中に一緒に封入するのです。VLPを精製し、その内容物を分析することで結合相手を探索できます。
CRDSATタグは、還元条件下であってもラクトース樹脂による精製が可能な特殊なタグです (CRDSAT generated by pCARGHO: a new efficient lectin-based affinity tag method for safe, simple, and low-cost protein purification. Biotechnol. J. 2017)。
タンパク発現量を誘導的に変化させるためのタグ
最近は、タグタンパク質の存在量を選択的に制御できるようなデグロン付きのタグもいろいろ開発されています。
Small Molecule Assisted Shutoff (SMASh) タグ (304アミノ酸) は、C型肝炎ウイルスのプロテアーゼ認識部位と、タグとデグロンが融合された構造になっています。SMAShタグをつけた目的のタンパクは、プロテアーゼ阻害剤がない条件ではデグロン部分がすぐに切り離されるので目的タンパクは残るのに対し、プロテアーゼ阻害剤を加えるとデグロン部分が目的のタンパクから切り出されなくなるので、結果としてタンパク質がデグロンの効果で分解されるという、誘導性プロテアソーム分解ができるタグです (Tunable and reversible drug control of protein production via a self-excising degron. Nat. Chem. Biol. 2015)。
low-temperature (lt) デグロンも発表され、温度依存的なタンパク分解ができるようになっています(Phenotypes on demand via switchable target protein degradation in multicellular organisms. Nat. Commun. 2016)。
このタグは現状ではN末にしかつけられないようですが、いずれ改良されてくるのでしょう。これらの分解タグは、タンパク質の厳密な調節が観察される研究に特に有用です。
近接ラベリングシステム
近傍のタンパクをビオチン標識するBioIDやAPEXといったシステム (近接ラベリング手法) もあります。
大腸菌ビオチンリガーゼBirAのR118G変異体 (A promiscuous biotin ligase fusion protein identifies proximal and interacting proteins in mammalian cells. J. Cell Biol. 2012)、植物ペルオキシダーゼAPXの遺伝子改変酵素 (Proteomic mapping of mitochondria in living cells via spatially restricted enzymatic tagging. Science 2013)という、ビオチン化をする酵素を調べたいbaitタンパク質に融合させると、近接のpreyタンパク質がビオチン化されるので、これを精製してくるという実験系です。
どちらも、従来の精製プロトコルとは対照的に、タンパク質複合体を抽出して精製するまでの間に壊れてしまっていても大丈夫というメリットがあります。
より高い活性を持つBioID/APEXの改良バージョンが発表され、BioID2 (232アミノ酸, An improved smaller biotin ligase for BioID proximity labeling. Mol. Biol. Cell. 2016) およびAPEX2 (249アミノ酸, Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat. Methods 2015)と言われています。
BioIDの標識時間は比較的長かったのですが、これを短縮したTurboID(321アミノ酸)という手法が開発され、わずか10分でビオチンラベルができるようになりました (Efficient proximity labeling in living cells and organisms with TurboID. Nat. Biotechnol 2018)。
まとめ
最後に今回の内容をまとめます。
- よく知られているタグもアポトーシスの時には使えないなど弱点がある
- タンパク質精製タグはどんどん開発が進んでいる (古典的なタグしか知らないのは危険)
- 精製だけでなく、さまざまな機能が付加されたタグもある
今日も【医学・生命科学のポータルサイト】生命医学をハックするをお読みいただきありがとうございました。